1.2. Фуллерены и их производные
Молекула фуллерена С60 состоит из 20 шестиугольников и 12 пятиугольников, в вершинах которых находятся атомы углерода, и обладает высокой симметрией (точечная группа Ih). Все атомы углерода в молекуле эквивалентны. Как следствие, спектр ЯМР 13С фуллерена С60 состоит только из одной узкой линии. Радиус фуллерена С60 равен 0.3512 нм, длина короткой связи, разделяющей шестиугольники, равна 0.1391 нм, а длина длинной связи, общей для шести- и пятиугольников – 0.1455 нм. Каждый атом углерода в молекуле фуллерена С60 связан с тремя другими атомами углерода одной короткой и двумя длинными связями. Сферическая форма молекулы приводит к тому, что угол между осью симметрии p-орбитали и направлением сигма связи отличается от 90о, что характерно для атомов углерода с sp2-гибридизацией. Эта особенность гибридизации атомных орбиталей углерода в молекуле называется пирамидализацией. Степень пирамидализации различна для молекул фуллерена разного состава. Пирамидализация обусловливает большое сродство к электрону фуллеренов.
Для удобства восприятия пространственное строение сферических молекул, в том числе и фуллеренов, отображается диаграммами Шлегеля. Последние представляют собой наглядные изображения (графы), которые отвечают геометрическим фигурам, расположенным на сферической (фуллерены) или на цилиндрической (нанотрубки) поверхности. На рис. 1.2 приводится диаграмма Шлегеля для фуллерена С60, а также другие его схематические изображения.
Фуллерен С60 обладает икосаэдрической симметрией. Квантово-механические расчеты показывают, что в нем валентные электроны должны быть распределены более или менее равномерно по сферической оболочке толщиной примерно 8 а. е. (1 а. е. = 0.0529 нм). Причем в центре фуллерена должна оставаться практически свободная от электронов полость радиусом около 2 а. е., так что молекула С60 является как бы пустой клеткой, куда могут входить атомы других элементов. Вначале теоретически, а затем экспериментально было показано, что во внутреннюю полость фуллерена С60 проникают различные атомы и образуется эндоэндральный комплекс.
Фуллерены в кристаллическом состоянии принято называть фуллеритами. Для фуллерита С60, имеющего при комнатной температуре гранецентрированную кубическую (ГЦК) решетку, расстояние между центрами ближайших шаров С60 составляет ~1.0 нм. При понижении температуры ГЦК решетка переходит в простую кубическую (ПК). Фазовый переход ГЦК в ПК в чистом фуллерите имеет место при 255 К [17]. При этом фазовом переходе не только меняется тип решетки, но и затормаживается вращение молекул фуллерена вокруг своего центра тяжести.
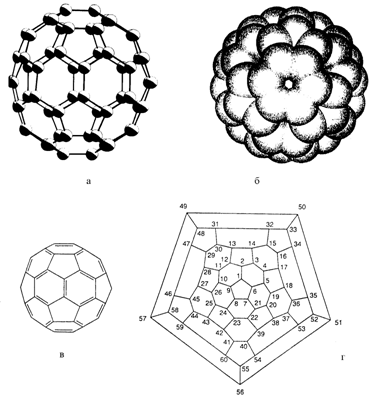
Рис. 1.2. Схематическое изображение фуллерена С60: а - в виде модели, в которой шары атомов углерода соединены стержнями; б - в виде электронного облака; в - с указанием двойных связей; г - диаграмма Шлегеля с пронумерованными атомами углерода.
Молекулы фуллерена в кристалле связаны слабыми ван-дер-ваальсовыми силами. Очевидно, что решетка, состоящая из больших шаров, имеет достаточно большие полости, которые могут заполняться молекулами растворителя, если молекулы последнего имеют размер, который позволяет им вписываться в имеющиеся полости. Кристаллы такого типа называются клатратными кристаллами. Как правило, клатраты имеют состав С60(Solv)х, где х меньше или равно 1. Если растворитель образует с фуллереном соединения донорно-акцепторного типа, то при медленном испарении растворов с такими соединениями могут образовываться кристаллосольваты. Кристаллическая решетка таких кристаллов может быть самой разнообразной, но ее симметрия обычно ниже таковой у чистого фуллерита. Для многих клатратных и сольватных кристаллов также были обнаружены фазовые переходы, обусловленные ориентационным упорядочением молекул в фуллерите. Отметим, что температура фазовых переходов у таких кристаллов ниже 255 К.
Согласно расчетам по методу молекулярных орбиталей (МО) ГЦК решетка фуллерита С60 описывается рядом неперекрывающихся зон [18]. Верхняя,полностью занятая электронами зона, образованная hu МО состояниями, отстоит от нижней свободной зоны (t1u МО состояния) на примерно1.5 эВ. Это расстояние (ширина запрещенной зоны) является важным параметром, определяющим электрические свойства фуллерита. Экспериментальные данные о ширине запрещенной зоны, которые, как правило, определяют из спектра оптического поглощения, согласуются с результатами теоретических расчетов. В настоящее время принято считать, что фуллерит С60 с ГЦК решеткой является полупроводником с шириной запрещенной зоны 1.5-1.8 эВ (см., например, [19]).
Широко известно, что свойства полупроводников можно существенным образом изменять путем их допирования. Допант может либо отдавать свои электроны в зону проводимости полупроводника (допант n-типа), либо забирать электроны из валентной зоны полупроводника (допант p-типа). При обработке фуллерита С60 парами щелочных металлов происходит его допирование по n-типу, электрон щелочного металла попадает в зону проводимости, образованную
t1u-состояниями.
На рис. 1.3 представлены фотоэмиссионные спектры образцов фуллерита С60, допированного калием, т. е KxC60 (рисунок взят из [19]). Видно, что при допировании вблизи уровня Ферми (Eb = 0) появляется новая полоса, интенсивность которой растет с увеличением кон¬центрации допанта х. Емкость валентной зоны, образованной t1g-состояниями, ограничена 6-ю электронами (в расчете на одну молекулу фуллерена). Поэтому при х больше 0 и меньше 3 проводимость образца растет с увеличением х, а при х = 6 зона проводимости оказывается заполненной полностью и свойства образца зависят от того, какая структура следующей свободной зоны, которая образуется t1g МО состояниями.
При х = 3 зона проводимости заполнена наполовину. Именно в этом случае, как уже сообщалось, образец приобретает способность переходить в сверхпроводящее состояние при 19 K.
Фуллерены могут образовывать соединения с атомами, молекулами, ионами, радикалами и прочими видами частиц. При этом частицы могут присоединяться как снаружи молекулы фуллерена (экзосоединения), так и изнутри молекулы (эндосоединения). Экзосоединения фуллерена со щелочными и щелочно-земельными металлами принято называть фуллеридами. Обнаружение сверхпроводящих свойств у образцов состава М3C60 (табл. 1.1) явилось одним из мощных стимулов для дальнейших работ по физике и химии фуллеренов.

Рис. 1.3. Фотоэмиссионные спектры KxC60.
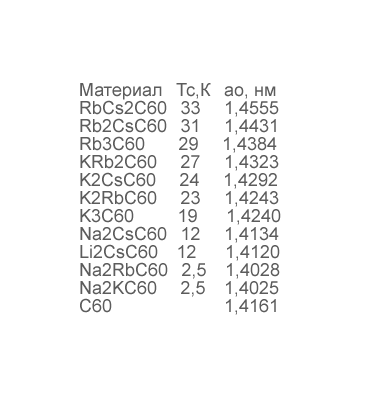
Таблица 1.1. Значения критической температуры сверхпроводимости фуллеридов щелочных металлов и параметры решетки ГЦК структуры.
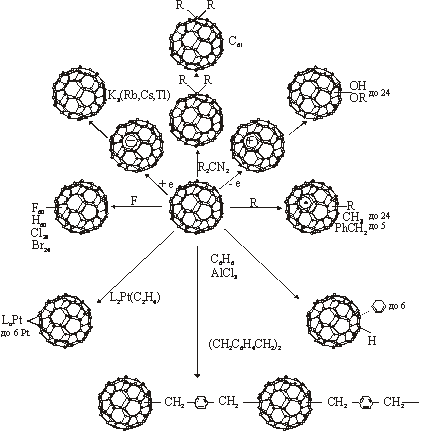
Рис. 1.4. Примеры химических реакций с участием фуллеренов.
Очень интересны химические свойства фуллеренов (рис. 1.4) [20-29]. Молекулы фуллерена способны легко принимать до шести электронов, образуя соответствующие полианионы. Фуллерены могут присоединять большое число различных реагентов как с сохранением остова С60, так и с его расширением. Они могут образовывать разнообразные молекулярные комплексы и ион-радикальные соединения. Фуллерены способны "впитывать" значительное количество свободных радикалов, образуя новые стабильные радикалы. Как полинепредельные соединения, фуллерены могут образовывать различные полимеры.
Возможности получения фуллереновых производных с разнообразными физическими и химическими свойствами, в том числе проявляющих биохимическую активность, вызывают огромный интерес исследователей в различных областях науки и техники.
Путем замещения одного или нескольких атомов углерода в фуллерене атомами других элементов, т. е. легированием фуллеренов, можно получать новые соединения, например С59N, С59В и т. д. Однако в настоящее время такие соединения мало изучены.
В принципе, могут существовать молекулы из атомов углерода, состоящие из семи- и пятичленных колец. Их принято называть азуренами, поскольку 5-, 7-членный фрагмент называется азуленом . Молекула самого простого азурена С28 состоит из двух семичленных и четырнадцати пятичленных циклов.




